Соляная кислота – это общее название для соляной кислоты, очень агрессивного химического вещества. Это соединение имеет многочисленные промышленные и бытовые применения, начиная от обработки продуктов питания, металлов и полимеров и заканчивая обеззараживанием воды в бассейне. Даже в разбавленной форме соляная кислота может раздражать глаза и кожу и вызывать проблемы с дыханием. В концентрированных количествах это может вызвать серьезные химические ожоги и даже смерть. Вы должны нейтрализовать любой разлив, смешивая его с мягкой основой, прежде чем очистить разлив.
Химические реакции
Нейтрализация кислоты происходит, когда она объединяется с основанием для производства соли и воды. Соляная кислота состоит из положительно заряженных ионов водорода и отрицательно заряженных ионов хлора. Основная жидкость, такая как едкий натр (гидроксид натрия), состоит из положительно заряженных ионов натрия и отрицательно заряженных гидроксильных ионов. Во время реакции ионы водорода и гидроксила объединяются, образуя воду, в то время как ионы хлора и натрия объединяются, образуя хлорид натрия, известный как поваренная соль. Более слабые основные вещества, такие как пищевая сода (бикарбонат натрия), кальцинированная сода (карбонат натрия) и известь (карбонат кальция) распадаются на положительные ионы натрия или кальция и отрицательные ионы карбоната в кислоте. Водород и карбонат-ионы объединяются, чтобы произвести газ углекислого газа в эффекте шипения вместе с водой. Ионы металла и хлорида объединяются, чтобы произвести соль хлорида натрия или кальция.
Тепло от химической реакции
Кислотная нейтрализация является сильно экзотермической реакцией, что означает, что она производит большое количество тепла, которое может испарять любую произведенную воду. Любой углекислый газ, который образуется в результате небольшой реакции нейтрализации, может раздражать ваши глаза и горло, хотя он не будет в достаточно больших объемах, чтобы быть смертельным. Чтобы свести к минимуму тепло и углекислый газ, медленно и постепенно добавляйте базовый материал в соляную кислоту.
Защитная одежда
Для защиты глаз и кожи следует использовать совместимые с кислотой перчатки – например, из неопрена или нитрила – так как латексные перчатки растворяются в кислоте. Любой источник пламени или воспламенения должен быть выключен.
Небольшие разливы
Пищевая сода, кальцинированная сода и известь являются наиболее безопасными и экономичными методами нейтрализации небольших или бытовых разливов соляной кислоты. Медленно разбрызгивайте нейтрализатор по краям разлива, а затем по направлению к центру, чтобы свести к минимуму пенообразование углекислого газа. После того, как вы нейтрализовали разлив, покройте его сухим песком, почвой или другим инертным материалом – таким как вермикулит – и поместите его в специальный контейнер для химических отходов и утилизируйте.
Большие разливы
Известняк и доломит (карбонат кальция-магния) являются распространенными нейтрализующими агентами для крупных разливов соляной кислоты и других кислот в естественных водоемах и в потоках воды из угольных шахт. Оба материала реагируют с кислотой в течение примерно 15 минут с образованием солей в шламе, с которыми легко обращаться и удалять. Известняк является лучшим реагентом из двух.

H2SO4 – вещество, способное растворяться в воде и выделять при этом большое количество тепла. Его 100-процентная концентрация при температуре больше +10 С затвердевает и становится кристаллической массой. Раствор используют в фармакологии и медицине, для диагностики желудочных заболеваний.
Но при всех её удивительных способностях, серная кислота способна нанести немалый урон или причинить ожог. Как распространённая сода способна помочь в нейтрализации?
О серной кислоте побольше
Данное вещество — это результат взаимодействия воды с серой. Два атома водорода и кислотный остаток составляют его формулу. Интересно, что способность растворяться в воде без нейтрализации давно используется в промышленности, когда нужно осушить газ.
Кислота забирает на себя воду, оставляя газ нетронутым (за исключением случаев, когда с ним реагирует). При соприкосновении с углеводами тоже происходит необычное – раствор их обугливает. Это объясняется химически: происходит реакция, где углевод отдаёт водород и кислород, а остаётся уголь.
Как кислота, раствор H2SO4 реагирует с метиловым оранжевым, перекрашивая его в красный. Она способна окислять практически все металлы, кроме:


Реакция нейтрализации
Сама реакция представляет собой взаимодействие основания и кислоты. Обязательным условием является образование воды и кислотной соли. Чем менее сильная кислота, тем больше воды выделяется.
Нейтрализацию часто используют в лабораториях, чтобы выяснить объём жидкости, нужный для реакции. То есть, если известна концентрация раствора, необходимо провести реакцию, постепенно добавляя второй компонент.
Предельное количество добавляемого компонента, при котором будет проходить реакция используют для проведения расчётов.
Действует такая формула: кислоту нейтрализуют щёлочью и наоборот. Ионное уравнение часто будет выглядеть подобным образом:
Каждая реакция нейтрализации может быть обратимой или необратимой в зависимости от компонентов – распадаются ли они при реакции. Необратимым считается взаимодействие сильных кислот и оснований, но остальные сочетания веществ будут распадаться.
Сода – слабая щёлочь, а это обуславливает обратимость реакции независимо от того, насколько концентрированной будет H2SO4. Когда же возникает необходимость нейтрализовать это агрессивное вещество?

Зачем необходимо нейтрализовать
Полезное вещество добавляют в лекарства, краски, удобрения, взрывчатку – и это ещё не весь список. Но, соприкасаясь с H2SO4, человек может получить ожоги, случайно выпить её или облить на себя. Также необходимость нейтрализовать возникает после проведения опыта с использованием данного компонента. Способов это сделать несколько:
- С помощью металлов, таких как цинк, медь.
- Оксидами металлов.
- Щёлочь, гидроксид натрия и сода как наиболее яркий пример.
- Гидроксидом аммиака.
Если на кожу попала кислота, её промывают под проточной водой и нейтрализуют опасное вещество, прикладывая повязку, промоченную 2% раствором соды. Необходимость использования вышеперечисленных веществ возникает не только при экстренных ситуациях: H2SO4 быстро испаряется, так что в воздухе оказывается 300 мг на 1м 2 . А потому отработанный материал оставлять крайне опасно.
Взаимодействие соды и серной кислоты
Сода – слабая щёлочь, которая используется для гашения лимонной кислоты, уксусной и серной, в том числе. NaHCO3 вступает в гомогенную реакцию с ними, обмениваясь атомами. Вот как выглядит уравнение для концентрированной серной кислоты:

Происходит вот что: формируется кислотный остаток, выделяется углекислый газ и вода. Оксид водорода появляется из-за взаимодействия карбонат ионов соли и водорода. Оба вида ионов образуются в процессе диссоциации кислоты. Разбавленная H2SO4 требует меньшего количества соды:

Что образуется при взаимодействии
Кислотный остаток уже не так опасен, как исходный компонент. Интересно, что именно реакции с выделением углекислого газа сода обязана добавлением её в хлеб – углекислый газ, выделяющийся из-за взаимодействия с молочной кислотой, поднимает тесто и делает в нём пузырьки.
Примерно также происходит реакция нейтрализации: основание вступает в реакцию с H2SO4 и выделяется углекислый газ. Поэтому, чтобы этот химический опыт не превратился в плачевный жизненный, следует проводить его в проветриваемом помещении.
К вопросу о том, сколько соды необходимо для нейтрализации H2SO4. Если взять 1 часть кислоты, пригодится 1 часть щёлочи для реакции с ней, то есть соотношение будет 1:1. Но концентрированная кислота требует больше соды, здесь соотношение увеличится до 1:2. Раствор соды необходим 3%.
Кроме того, если необходимо оказать помощь при ожоге кислотой, то готовится раствор соды в очень приблизительном количестве: 1 чайная ложка щёлочи и на 2,5 стакана воды. Насколько эффективна реакция? В этом помогут разобраться отзывы тех, кто с ней часто сталкивается.
Отзывы
Автолюбители прекрасно знают, что электролит в аккумуляторе содержит 30-35% серной кислоты (если плотность 1,26). Чтобы его утилизировать они используют именно пищевую соду. На всю жидкость уходит 1,5 пачки соды. Положительным отзывом этот способ нейтрализации обязан стоимости соды и её доступности – щелочь легко можно приобрести в продуктовом магазине.
На форумах можно найти другой способ нейтрализации, с помощью силиката натрия. Он имеет право на существование, но сода в этом случае имеет бесспорное преимущество: в результате реакции с силикатом натрия выпадает осадком кремневая кислота, которую, увы, очень сложно вымыть. Результат реакции с содой – появляется карбонат ионов соли, безопасный и легко смываемый, что обуславливает большое количество положительных отзывов.
Очень интересный вопрос был обнаружен на одном из форумов. Он касался выпечки: в ней есть сода, которая теоретически может реагировать с желудочным соком (H2SO4). В результате должна образоваться в желудке соль, а вся проблема в том, что человек сидел на бессолевой диете. Пользователи успокоили волнующегося, что для реакции нейтрализации необходимо большое количество соды, а в выпечке она измеряется маленькими ложками.
Среди отзывов можно найти немало полезных советов: сыпать щёлочь лучше понемногу, чтобы пена не выходила из узкой пробирки струёй, перед утилизацией раствора разводить его дополнительно водой и проводить реакцию в проветриваемом помещении. Таким образом опасная H2SO4 не причинит вреда, если её правильно утилизировать содой.
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги;  особенно опасны щелочные ожоги. Пары негативно влияют на дыхательную систему, вызывая раздражение дыхательных путей и даже отек легких. Кроме этого, во многих реакциях с этими соединениями образуется водород — горючий и взрывоопасный газ. Именно поэтому большинство опытов с ними следует проводить в вытяжном шкафу. Очень опасны концентрированные кислоты: азотная и серная. Их контакт с органическими материалами может привести к самовозгоранию последних.
особенно опасны щелочные ожоги. Пары негативно влияют на дыхательную систему, вызывая раздражение дыхательных путей и даже отек легких. Кроме этого, во многих реакциях с этими соединениями образуется водород — горючий и взрывоопасный газ. Именно поэтому большинство опытов с ними следует проводить в вытяжном шкафу. Очень опасны концентрированные кислоты: азотная и серная. Их контакт с органическими материалами может привести к самовозгоранию последних.
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
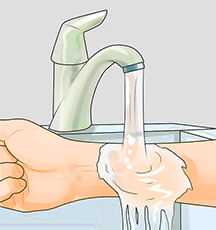 • Место ожога кислотой заливают 1%-ным раствором питьевой соды.
• Место ожога кислотой заливают 1%-ным раствором питьевой соды.
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер  вещества. Кислоты засыпаются только песком — ни в коем случае не опилками! Щелочи засыпают опилками или песком.
вещества. Кислоты засыпаются только песком — ни в коем случае не опилками! Щелочи засыпают опилками или песком.
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы. Следует принять меры предосторожности, необходимые при контакте с кислотами или щелочами; использовать резиновую обувь, перчатки и респираторы, очки.
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
>

